Erstelle die Strukturformeln aller Propanole, Butanole und Pentanole. Die Daten sind dem "Datenblatt Alkanole" zu entnehmen.
Benenne zuerst die sekund�ren Bindungskr�fte, die f�r die H�he des Siedepunkt verantwortlich sind.
- Begr�nde den Zusammenhang zwischen der Struktur und dem Siedepunkt unter der Fragestellung: Wie kann sich die f�r den Siedepunkt verantwortlichen sekund�ren Bindungskraft aufgrund der gegebenen Molek�lgestalt auswirken?
| | Prim�res, sekund�res, terti�res und quart�res C-Atom | prim�rer Alkohol | sekund�rer Alkohol | terti�rer Alkohol | quart�res C-Atom | | CH3CH2CH2CH2OH | CH3CH2CHCH3
|
OH | | | | 1-Butanol | | 2-Methyl-2-propanol | | Das die OH-Gruppe tragende C-Atom ist ein prim�res C-Atom, da es nur an ein weiteres C-Atom gebunden ist. | Das die OH-Gruppe tragende C-Atom ist ein sekund�res C-Atom, da es an zwei weitere C-Atome gebunden ist. | Das die OH-Gruppe tragende C-Atom ist ein terti�res C-Atom, da es an drei weitere C-Atome gebunden ist. | Das zentrale C-Atom tr�gt vier weitere C-Atome.
Sekund�rbindungskr�fte | Bei den Alkanolen bestimmen zwei Sekund�rbindungskr�fte die H�he der Siedepunkte: die Wasserstoffbr�ckenbindung WBB und die Van-der-Waals-Kraft (VdWK). |
Arbeitsauftr�ge: 1. 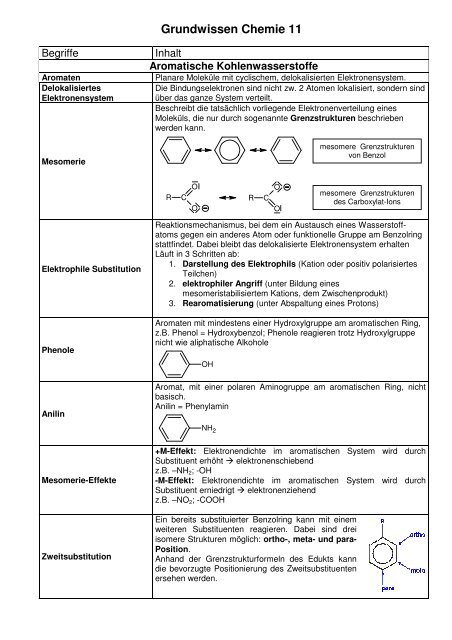 Austausch digitaler Unterrichtseinheiten mit anderen Schulen Schulmanager, Digitales Klassenbuch und Elternportal, um die Schulabläufe digital zu organisieren. Das Verzeichnis für Privatschulen und Internate in Deutschland Der exklusive Online-Shop für Schulen, Lehrer, Dozenten, Schüler und Studenten seit über 30 Jahren
�bungsaufgaben zu Bindungstypen (II)Stoffname | Formel | Typ der Prim�rbindung | Typ der Skb | | Bsp: Natriumchlorid | NaCl | Ionenbindung | Ionenbindung | | Aluminiumfluorid | AlF3 | Ionenbindung | Ionenbindung | | Methan | CH4 | Molek�lbindung, unpolar | Van-der-Waals-Bindung | | Methylchlorid | CH3Cl | Molek�lbindung, polar | Dipol-Dipol-Bindung | | Ammoniak | NH3 | Molek�lbindung, polar | Wasserstoffbr�ckenbindung | | Acetaldehyd | CH3-CHO | Molek�lbindung, polar | Dipol-Dipol-Bindung | | Pentanol | CH3-CH2-CH2-CH2-CH2-OH | Molek�lbindung, polar | Van-der-Waals-Bindung > Wasserstoffbr�ckenbindung | | Magnesiumoxid | MgO | Ionenbindung | Ionenbindung | | Eisen | Fe | Metallbindung | Metallbindung | | Iod | I2 | Molek�lbindung, unpolar | Van-der-Waals-Bindung | | Germaniumwasserstoff | GeH4 | Molek�lbindung, unpolar | Van-der-Waals-Bindung | | Ethanol | CH3-CH2-OH | Molek�lbindung, polar | Wasserstoffbr�ckenbindung > Dipol-Dipol-Bindung | | Propylamin | CH3-CH2-CH2-NH2 | Molek�lbindung, polar | Wasserstoffbr�ckenbindung > Van-der-Waals-Bindung | | Diethylether | CH3-CH2-O-CH2-CH3 | Molek�lbindung, polar | Dipol-Dipol-Bindung > Van-der-Waals-Bindung | | Fluorethan | C2H5F | Molek�lbindung, polar | Dipol-Dipol-Bindung | | Dodecanol | CH3-(CH2)11-OH | Molek�lbindung, schwach polar | Van-der-Waals-Bindung | | Methanal-L�sung | HCHO(aq) | Molek�lbindung, polar | Wasserstoffbr�ckenbindung | | Bariumchlorid | BaCl2 | Ionenbindung | Ionenbindung | | Diethylketon | CH3-CH2-CO-CH2-CH3 | Molek�lbindung, polar | Dipol-Dipol-Bindung > Van-der-Waals-Bindung | | Butadien | C4H6 | Molek�lbindung, schwach polar | Van-der-Waals-Bindung | | 1,4-Dichlorbutan | Cl-(CH2)4-Cl | Molek�lbindung, polar | Dipol-Dipol-Bindung > Van-der-Waals-Bindung | | Kohlenmonoxid | CO | Molek�lbindung, polar | Dipol-Dipol-Bindung | | Methanal | HCHO | Molek�lbindung, polar | Dipol-Dipol-Bindung | | Schwefelwasserstoff | H2S | Molek�lbindung, schwach polar | Dipol-Dipol-Bindung | | Phosphorpentachlorid | PCl5 | Molek�lbindung, polar | Dipol-Dipol-Bindung | | Essigs�ure | CH3COOH | Molek�lbindung, polar | Wasserstoffbr�ckenbindung | �bungen zur Ermittlung der Oxidationszahl organischer VerbindungenVorgabe: Tabelle organische Verbindungen | Methan | Ethan | Propan | 2-Methyl-propan | | Methanol | Ethanol | Propanol-2 | tert.-Butanol | | Formaldehyd = Methanal | Acetaldeyd | Aceton = Dimethylketon | Propions�ure | | Ameisens�ure | Essigs�ure | Essigs�ureethylester | Ameisens�uremethylester |
Aufgabenstellung:
1.
F�lle die L�cken in der 2.  Die entsprechenden Formeln sind dem "Datenblatt Alkanole" zu entnehmen. | 2. Abh�ngigkeit des Siedepunkts von der Struktur der Propanole, Butanole und Pentanole | | | 3. (Name des Alkohols?), 3. Isomere des Hexanols | L�sungshinweis: Es gibt 17 Isomere, davon sind drei dem Hexanol zu zu rechnen.
Teil der Aufgaben Klassifizierung der Pentanole nach der Art des C-Atoms | Ein prim�res C-Atom besitzen: 1-Pentanol, 2-Methyl-1-butanol, 3-Methyl-1-butanol, 2,2-Dimethyl-1-propanol Ein sekund�res C-Atom besitzen: 2-Pentanol, 3-Pentanol, 3-Methyl-2-butanol Ein terti�res C-Atom besitzen: 2-Methyl-2-butanol | 3.
|
|
| 


