Schwefel sauerstoff reaktionsgleichung
Nichtmetalle reagieren mit Sauerstoff
Beobachtung:Schwefel verbrennt mit schwach blauer Flamme.
Versuch 2:
Beobachtung:Schwefel verbrennt mit intensiv leuchtender blauer Flamme, es bildet sich ein farbloses, stechend riechendes, Nebel bildendes gasf�rmiges Oxid
Reaktionsschema: Schwefel (l) + Sauerstoff (g) -----> Schwefeldioxid (g) + W�rme
Versuch 3:Beobachtung: Schwefeldioxid bleicht den Bl�tenfarbstoff
Versuch 4:
Beobachtung:Die Holzkohle verbrennt unter hellem Gl�hen.
Reaktionsschema: Kohlenstoff (s) + Sauerstoff (g) ----> Kohlenstoffdioxid (g) + W�rme
Versuch 5:Beobachtung:Das Kalkwasser tr�bt sich milchig wei�.
Reaktionsschema: Kohlenstoffdioxid (g) + Kalkwasser (aq) -----> Kalk (s) + Wasser (l)
Eigenschaften von Kohlenstoffdioxid
Versuch 6:Kohlenstoffdioxid
Beobachtung: Die Kerzen gehen von unten nach oben langsam aus.
Schlussfolgerung:Kohlenstoffdioxid l�scht die Flamme, es erstickt also die Verbrennung.
Es liegt auch ein Text vor, den man gleichzeitig vorlesen kann.
Serie starten
Arbeitsblatt doc docx pdf
Vorlesetext doc docx pdf
Schwefelsäuresynthese im Modellversuch
| Beim ersten Brenner (links) wird Pyrit zu Schwefeldioxidgeröstet.
Die Serie kann zur Erarbeitung des Arbeitsblattes verwendet werden. Anschließend wird der brennende Schwefel in einen mit Sauerstoff gefüllten Standzylinder gehalten. BeobachtungDer brennende Schwefel weist in der Luft eine schwach blau leuchtende Flamme auf (Abb. Die Lösungen werden beim Durchklicken im Vollbildmodus nach und nach eingeblendet. Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Daher sind die einzelnen Horden durch Wärmeaustauscher voneinander getrennt.  Schritt
LiteraturE. Beim Doppelkontaktverfahren wird das verbleibende Schwefeldioxid nach dem Durchgang durch den Zwischenabsorber nochmals über eine Kontaktschicht geleitet. Auf der anderen Seite wäre der Effekt durch den Sauerstoff in diesem Fall nicht so gut zu beobachten wie beim Schwefel. Dies kann in einem weiteren Versuch nachgewiesen werden. Schritt Die Reaktion wird durch den Einsatz von Katalysatoren wie Vanadiumoxid und durch einen exakt berechneten Anteil an Sauerstoff im Überschuss begünstigt. Daher erfolgt die Verbrennung von Schwefel in reinem Sauerstoff schneller als in der Luft.  Es sind mehrere solcher Horden hintereinander angeordnet. Im mit Sauerstoff gefüllten Standzylinder ist die Flamme leuchtend blau (Abb. 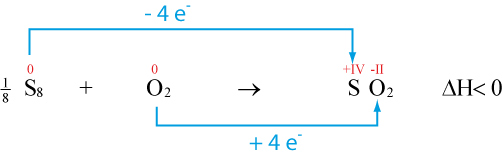 Dies zeigt sich in der deutlich heller leuchtenden Flamme beim Schwefel. Anmerkungen & Unterrichtsanschlüsse: Dieser Versuch eignet sich, um Oxide von Nichtmetallen, in diesem Fall Schwefel, einzuführen. Diese beträgt im oberen Teil des nachgeschalteten Kontaktofens etwa 420 °C. Am Vanadium(V)-oxid-Katalysator (2. Dischwefelsäure würde entstehen, wenn Schwefeltrioxid in konzentrierte Schwefelsäure eingeleitet wird: Das Schwefeltrioxid reagiert mit dem Wasseranteil in der leicht verdünnten Säure: Moderne Anlagen erreichen eine Umsetzung des Schwefeldioxids von mindestens 99,8%. Serienbilder zur Schwefelsäuresynthese Zur Schwefelsäuresynthese liegt eine Serie in 12 Bildern zur Lösungskontrolle vor. Die Wärmeaustauscher leiten überschüssige Wärme ab. 3.Schritt Im Absorber wird das Schwefeltrioxid mit 96%iger Schwefelsäure vermischt. reading. Exercise 11:
Exercise 2:
Exercise 10:
Search question By text By image/screenshot Ziel des Versuchs: In diesem Versuch wird Schwefel zunächst an der Luft entzündet und anschließend in einen mit Sauerstoff gefüllten Zylinder gehalten. MaterialienVerbrennungslöffel, Standzylinder, Bunsenbrenner ChemikalienSchwefel, Sauerstoff DurchführungEine Spatelportion Schwefel wird in einen Verbrennungslöffel gegeben und im Abzug über dem Bunsenbrenner entzündet. Nach dem Prinzip von Le Chatelier sinkt mit steigender Temperatur der Anteil an Schwefeltrioxid bei diesem chemischen Gleichgewicht, daher erweist sich eine Arbeitstemperatur von 420 bis 440 °C optimal. |